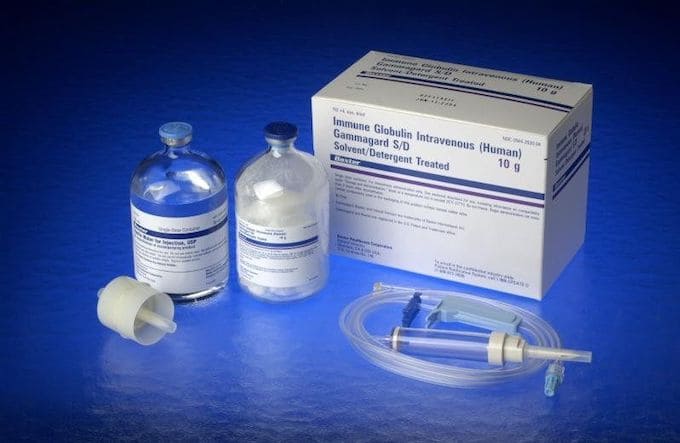
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), dependiente del Ministerio de Sanidad, ha emitido un comunicado informando de la retirada de un lote de Gammagard S/D 10 gramos, un medicamento que se utiliza en el entorno hospitalario y que pertenece al grupo de medicamentos de inmunoglobulinas.
Esta alerta se ha produccido tras "las cifras atípicas de reacciones adversas de tipo hipersensibilidad asociadas con el lote madre empleado en la fabricación de este lote de producto terminado".
Según detalla el organismo, el medicvamento afectado es el Gammagard S/D, en polvo y disolvente para solución para perfusión, distribuido en frasco, y el lote del medicamento afectado es el 'BE08C020AE', con fecha de caducidad el 31/08/2024., Además, incluye un frasco de disolvente, NR: 60718, CN: 685636.
Así las cosas, las autoridades sanitarias han ordenado la retirada de todas las unidades distribuidas del lote afectado y su devolución al laboratorio por los cauces habituales.
El seguimiento de esta actividad deberá estar controlado y supervisado por las comunidades autónomas, aunque la propia AEMPS ha clasificado la alerta de un riesgo intermedio, de categoría 2, por lo que el defecto del producto "no supone un riesgo vital para el paciente".
Gammagard S/D contiene anticuerpos humanos para el tratamiento de diversas infecciones, y se emplea cuando los pacientes no tienen suficientes anticuerpos en la sangre para combatir una infección.
"Estos pacientes suelen padecer infecciones con frecuencia. También se puede utilizar cuando se necesiten anticuerpos adicionales para la cura de determinados trastornos inflamatorios", ha detallado la AEMPS.